Сайт репетитора по химии и биологии Трофимова Д.А.
Главная страница <<предыдущая страница следующая страница>>
-->Перевод статьи: “Генетически модифицированные Т – клетки в раковой терапии: достоинства и недостатки” репетитором по химии и биологии Трофимовым Д. А. Авторы статьи: Михаела Шарпе и Наталия Маунт. Продолжение.
Т – лимфоциты и роль рецепторов Т – клеток.
Т – клетки (также известные как Т лимфоциты) широко распространены в тканях и окружающей среде опухолей. Они играют центральную роль в клеточном иммунитете и могут опосредовать ответы: антиген специфический - долгоживущий, эффекторный и иммунной памяти.
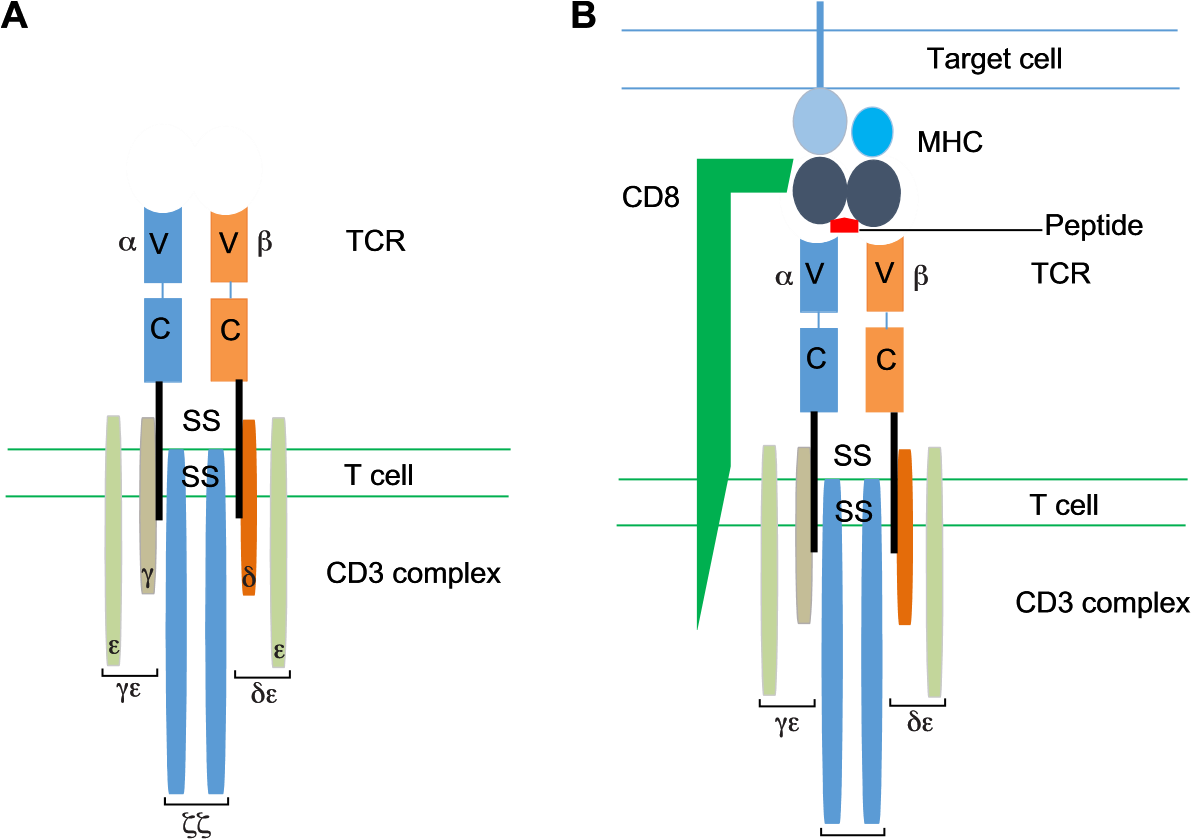
Т - клетки отличаются от других лимфоцитов наличием Т клеточных рецепторов (TCR)6а на поверхности клеток. TCR является мультисубъединицей трансмембранного комплекса, который определяет антиген специфическую активацию Т - клеток. TCR состоит из двух различных полипептидных цепей (рис.2А), TCR α и β цепи.
Структура и функции TCR. (A) Т-клеточный рецептор (TCR), обнаруженный на поверхности Т-клеток, отвечает за распознавание антигена. Он состоит из двух цепей: цепей альфа (α) и бета (β). Обе цепи имеют константную область (с) и вариабельную область (v), и именно вариабельная область определяет антигенную специфичность. TCR ассоциирован с комплексом CD3, который включает три молекулы трансмембранной сигнализации (CD3ζζ, CD3δε и CD3γε). (B) TCR будет взаимодействовать с антигеном на клетке-мишени, когда целевая пептидная последовательность презентирована соответствующим основным комплексом гистосовместимости (MHC-1 для цитотоксических T-клеток). Эффективная активация Т-клеток также требует одновременного связывания ко-рецептора Т-клеток (CD8 для цитотоксических Т-клеток). Ss, дисульфидный мост. Из статьи Genetically modified T cells in cancer therapy: opportunities and
challenges. Michaela Sharpe and Natalie Mount. Разместил рисунки со структурой и функциями TCR репетитор по химии и биологии Трофимов Д.А.
Обе цепи имеют изменяющуюся и постоянную область. Цепи связаны дисульфидной связью обеспечивая единый антигенсвязывающий сайт.TCR придает антигенную специфичность Т-клетки, путем распознавания антигена-лиганда, содержащего короткую непрерывную аминокислотную последовательность белка, который находится на клетки-мишени призентированный при помощью главного комплекса гистосовместимости молекул (MHC; глосарий 1). В состав Т – клеток входят молекулы распознавания, такие как CD4 для МНС класса II и CD86 для класса MHC I. TCR взаимодействует с этим лигандом путем установления контактов как с молекулой MHC, так и с антигеном пептида. Передачи сигнала происходит через ассоциированный инвариантный комплекс CD3, который состоит из четырех различных CD3 белков, которые образуют два гетеродимера (CD3δε и CD3γε) и один гомодимер (CD3ζζ) (рис. 2А). После контакта с их родственными пептидами, представленные молекулами МНС класса I, наивные CD8 + цитотоксические Т-клетки интенсивно размножаются и приобретают фенотипические и функциональные свойства, позволяющие им действовать в качестве эффекторных Т-клеток (вставка 1); они устраняют клетки, экспрессирующие антиген6в, через апоптоз-индуцирующие лиганды или высвобождением литических гранул. Кроме того, генерируются долговечные Т-клетки памяти (вставка 1), которые могут самообновляться, что позволяет быстро размножаться в присутствии антигена-мишени и обеспечивать устойчивый и стойкий ответ на него при повторном воздействии. Функция Т-клеток, как организаторов и эффекторов адаптивного иммунного ответа определяются специфичностью TCR. Примечание к разделу: "Т – лимфоциты и роль рецепторов Т – клеток".
6. CD4 является клеточным маркером Т – хелперов. Находясь на Т - хелперах, он принимает дополнительное участие в активации клеток. Его ко - рецепторная функция состоит в связывании с белком главного комплекса гистосовместимости класса I, присутствующим на поверхности почти всех ядерных клеток и презентирующим антиген микроорганизмов или раковых опухолей. По мимо того, что рецептор Т – клеток (TCR) связывается с антигеном антигенпрезентирующем белком I класса главного комплекса гистосовместимости (MHC), для активизации Т – хелпера необходимо также, чтобы белок CD4, соединился с молекулой MHC.
CD8 - клеточный маркер и ко - рецептор для Т – киллеров и выполняет аналогичную функцию для их активации.
Пояснение о функциях и отличаях ко- рецепторных белков CD4 и CD8 добавил репетитор по химии и биологии Трофимов Д. А.
6а. Как уже говорилось в примечании 3 к введению. На поверхности любой клетки не принадлежащей иммунной системе находятся молекулы МНС (ГКГС главного комплекса гистосовместимости) – белки I класса. Их главная задача сделать видимой для клеток защитников организма проникновение чужеродной инфекции в организм. Для этого белки инфекции поглощаются макрофагами (от др.-греч. μακρός — большой, и φάγος — пожиратель) содержащими ферменты – протеосомы (от англ. protease — протеиназа и лат. soma — тело) благодаря которым происходит расщепление белков до фрагментов с длинною 4- 25 амминокислотных остатков. Эти фрагменты - антигены выставляются на показ, т.е. презентируются делая явным инкогнито вражеского белка. Это осуществляют МНС- белки II класса находящиеся на поверхности клеток иммунной системы, которые захватывают образовавшиеся фрагменты. Распознают и взаимодейстуют с ними Т-хелперы. МНС- белки I класса макрофагов презентируют фрагменты вирусов для Т- киллеров, с которыми происходит взамодействие через эти белки макрофагов и рецепторы Т - киллеров ассоциированные с этими белками. Аналогично ведут себя обычные клетки, которые расщепляют белок вируса, бактерии или паразитов и презентируют его фрагмент, но с помощью только молекул ГКГС – белков I класса. Сигналы с рецепторов поверхности Т – лейкоцитов передаются с помощью разнородных полимеров CD3δε и CD3γε и одной двойной цепи однородных -CD3ζζ. Т- клетки делятся на Т-киллеры или цитотоксические клетки, которые уничтожают инфекцию самостоятельно, клонировавшись после соединения с макрофагом и образовав связь с МНС белком I класс зараженной клетки, несущим чужеродный фрагмент микроорганизма и на Т- хелперы, которые предпочитают участвовать в процессе уничтожения опосредственно. С этой целью они активируют В- клетки предварительно связавшись с МНС – белком II класса макрофага, который презентировал антиген, а уже В – клетки, рассердившись за то, что их разбудили, в свою очередь образуют множество антител, уничтожающих инородные микроорганизмы.
Пояснение о особенностях участия в иммунной системе Т- лейкоцитов и о строении их комплексов CD разместил репетитор по химии и биологии Трофимов Д. А.
6в. Белки кодируются азотистыми основаниями: аденином, тимином, гуанином и цитозином. Три азотистых основания - триплет в молекуле ДНК (дезоксирибонуклеиновой кислоте) кодирует определенную аминокислоту, а сочетание более ста аминокислотных остатков, называется белком. При меньшем их количестве – полипептидом. Только четыре кирпичика использует природа для строительства огромного разнообразия белков животных и растений. Находясь в ядре молекуле ДНК нет необходимости покидать этот, довольно-таки, уютный дом защищенный к тому же двойной оболочкой, безопасный и надежный. Но как тогда этот код попадет в рибосомы, фабрики по производству белков, которые находятся за пределами ядра? Громоздким молекулам ДНК (у дрозофилы, например, около 107 пар азотистых оснований) было бы достаточно проблематично устремится из мирной обители своей с благородной целью создания белков. Конечно пройти через поры ядерных оболочек диаметром около 90 нм (нано – 109 ) ДНК имеющей диаметр двойной спирали 2нм довольно легко, несмотря на солидную длину. Если же вдруг все ДНК человека захотят отправится в путешествие, то суммарная длина 46 молекул достигает 2 метров. Но обитатели клетки в лице органелл не поймут этого фортеля, который выкинут молекулы ДНК и также начнут чудить и творить всяческие беззакония, что в конечном счете приведет к полному разладу в слаженной работе клетки. Дабы предотвратить разлад в семье на помощь ДНК приходят РНК (рибонуклеиновые кислоты) которые и берут на себя ответственность за копирование ценнейших манускриптов, которые от зарождения жизни бережно передаются из поколения в поколение. Это небольшие и шустрые молекулы, которые не обладают бесценным тимином, но вместо него вполне довольствуются урацилом, при этом на качестве белка это не сказывается! На матрице ДНК они переписывают фрагменты кода того или иного белка входящий в состав гена, а помогает им в этом РНК - полимераза, которая является биологическим катализатором, то есть ускорителем химических реакций. Сам процесс называется транскрипция, что в переводе с тарабарского латинского языка означает переписывание, считывание. Переписанная информация о структуре одного белка на плечах иРНК (мРНК) информационной или матричной РНК бережно переносится за пределы ядра ее носителями, после чего молекулы устремляются так сказать, со всех ног, если бы они у них были, на перегонки к рибосомам. Той молекуле, которая первая добежит гарантируется приз в размере месячного оклада, если бы он был, конечно, или, по крайней мере, гордое звание самой шустрой молекулы иРНК и, заняв рибосому, она запускает слаженный механизм образования белка, называемый трансляция, что в переводе с того же, не совсем понятного латинского, означает перевод, то есть перевод кода иРНК на аминокислотную последовательность белка из которой он состоит.
Пояснение к понятию экспрессия написал репетитор по химии и биологии Трофимов Д. А.
Центральная и периферическая толерантность Хотя опухолевые антигены имеют потенциал, чтобы быть иммуногенными, потому что опухоли образуют из собственных клеток индивидуума только мутированные белки или белки с измененными трансляционными процессами (прим. трансляция- синтез белков на рибосомах) и будут рассматриваться иммунной системой как чужеродные, антигены, которые активируются или избыточно экспрессируются (так называемые аутоантигены), не обязательно вызывают функциональный иммунный ответ на опухоль: Т-клетки, экспрессирующие TCR, которые обладают высокой реакционной способностью к этим антигенам будут отрицательно отобраны (прим. отрицательно отобраны- подавлено их размножение) в тимусе в процессе, известном как центральная толерантность (см. вставку 1) (Хинг Хогкуист 2012 года; Руелла и Калос, 2014), а это означает, что остаются только Т-клетки с низким сродством TCR к аутоантигенам. Среда опухоли также играет ключевую роль в иммунном ответе. Для того чтобы Т-клетки стали активированными требуются. ко-стимуляторы сигнала, как правило, возникающие при связи с антиген-презентирующими клетками (таких как дендритные клетки, см. вставку 1). Тем не менее, опухолевые клетки могут недостаточно стимулировать антиген-презентирующие клетки, что приводит к недостаточной экспрессии МНС класса I- и II-пептидных молекул7, костимуляторных молекул и продукции цитокинов (Хавигер и др., 2001). Антиген-презентирующие клетки, поэтому, не могут в полностью взаимодействовать с Т-клетками. Это приводит к недостаточному росту их числа, слабой активации и пролиферации ( то есть размножения клеточным делением - прим. репетитора по химии и биологии Трофимова) Т-клеток. В результате чего наступает анергия (периферическая толерантность, см вставку 1). Кроме того, растет число данных свидетельствующих о том, что другой тип клеток, регуляторные Т-клетки (TRegs; вставка 1), играют основную роль в подавлении активности Т-клеток опухоли и являются главным препятствием для иммунных реакций против опухолей (Орманди и др. 2005; Джоу и Левицкий, 2007), что приводит к состоянию иммунного подавления. Общим результатом является увеличение выживаемости опухоли; цель терапии заключается в смещении на основе иммунных клеток баланса сил обратно к иммунной системе. Примечание к разделу: "Центральная и периферическая толерантность ".
7. Белки кодируются азотистыми основаниями: аденином, тимином, гуанином и цитозином. Три азотистых основания - триплет в молекуле ДНК (дезоксирибонуклеиновой кислоте) кодирует определенную аминокислоту, а сочетание более ста аминокислотных остатков, называется белком. При меньшем их количестве – полипептидом. Только четыре кирпичика использует природа для строительства огромного разнообразия белков животных и растений. Находясь в ядре молекуле ДНК нет необходимости покидать этот, довольно-таки, уютный дом защищенный к тому же двойной оболочкой, безопасный и надежный. Но как тогда этот код попадет в рибосомы, фабрики по производству белков, которые находятся за пределами ядра? Громоздким молекулам ДНК (у дрозофилы, например, около 107 пар азотистых оснований) было бы достаточно проблематично устремится из мирной обители своей с благородной целью создания белков. Конечно пройти через поры ядерных оболочек диаметром около 90 нм (нано – 109 ) ДНК имеющей диаметр двойной спирали 2нм довольно легко, несмотря на солидную длину. Если же вдруг все ДНК человека захотят отправится в путешествие, то суммарная длина 46 молекул достигает 2 метров. Но обитатели клетки в лице органелл не поймут этого фортеля, который выкинут молекулы ДНК и также начнут чудить и творить всяческие беззакония, что в конечном счете приведет к полному разладу в слаженной работе клетки. Дабы предотвратить разлад в семье на помощь ДНК приходят РНК (рибонуклеиновые кислоты) которые и берут на себя ответственность за копирование ценнейших манускриптов, которые от зарождения жизни бережно передаются из поколения в поколение. Это небольшие и шустрые молекулы, которые не обладают бесценным тимином, но вместо него вполне довольствуются урацилом, при этом на качестве белка это не сказывается! На матрице ДНК они переписывают фрагменты кода того или иного белка входящий в состав гена, а помогает им в этом РНК - полимераза, которая является биологическим катализатором, то есть ускорителем химических реакций. Сам процесс называется транскрипция, что в переводе с тарабарского латинского языка означает переписывание, считывание. Переписанная информация о структуре одного белка на плечах иРНК (мРНК) информационной или матричной РНК бережно переносится за пределы ядра ее носителями, после чего молекулы устремляются так сказать, со всех ног, если бы они у них были, на перегонки к рибосомам. Той молекуле, которая первая добежит гарантируется приз в размере месячного оклада, если бы он был, конечно, или, по крайней мере, гордое звание самой шустрой молекулы иРНК и, заняв рибосому, она запускает слаженный механизм образования белка, называемый трансляция, что в переводе с того же, не совсем понятного латинского, означает перевод, то есть перевод кода иРНК на аминокислотную последовательность белка из которой он состоит.
Коментарий к процессам идущим при экспрессии белков добавил репетитор по химии и биологии Трофимов Д. А. Генетически модифицированные Т-клетки в иммунотерапии рака. Концепция переноса Т-клеток пациентов (легко усваивающаяся пересадка Т-клеток) для лечения болезни была основана в течение многих лет на манипуляция Ex vivo 8, нацеленых на специфические вирусы, например, для лечения вирусных инфекций, таких как цитомегаловирус или вирусные инфекции Эпштейна-Барра, после трансплантации гемопоэтических стволовых клеток 9
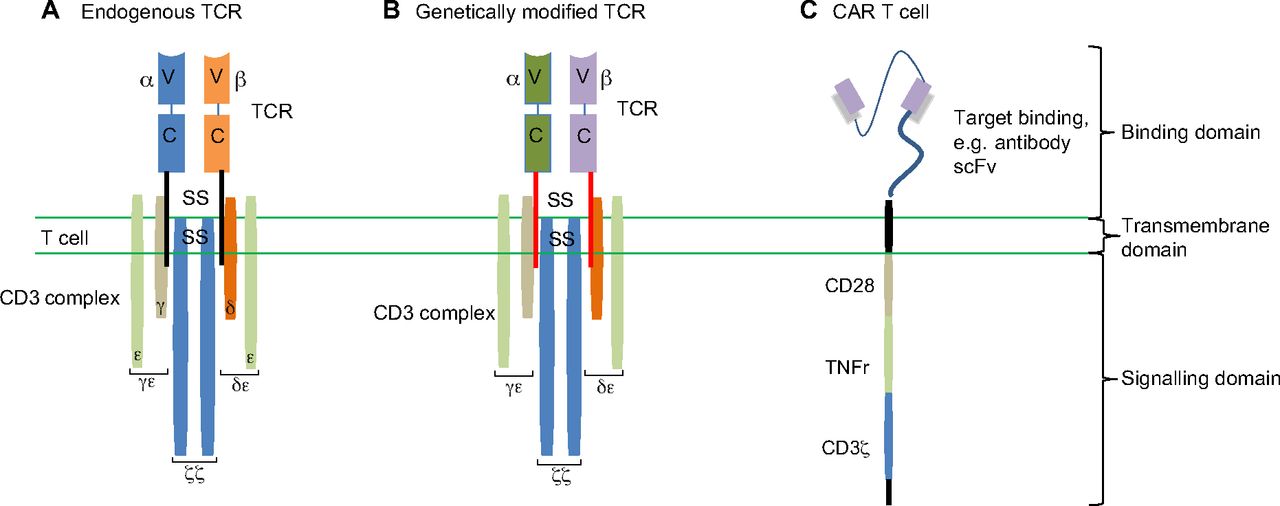
(Валтер и др., 1995; Хеслоп и др, 2010; Руни и Лин, 2012). Как было описано выше, редкие популяции опухолевых антиген-специфических Т-клеток существуют и специфично могут быть отделены на месте опухоли, и они известны как лимфоидная инфильтрация опухоли (TILs) (Каваками и др, 1994; Роббинс и др., 2013). TILs может быть выделены из вырезанной ткани опухоли, культивироване, активированы и размножены ex vivo и, по реинфузии, показали перспективную эффективность в клинике, в частности, в лечении меланомы (Rosenberg и др., 1988, Бессер и др., 2013 ; Kvistborg и др, 2012;. Dudley и др, 2013), поддерживая терапевтический потенциал опухоль-специфических Т-клеток. Альтернативный вариант этих подходов, который в настоящее время начинает демонстрировать убедительные клинические данные основаны на предположении, что антиген специфичностью Т-клеток можно манипулировать с помощью генетической модификации и перенаправлении к антигенам цели, которые экспрессируются опухолями. В частности, Т-клетки могут быть сконструированы для экспрессии модифицированных TCR (так называемые TCR терапии) или белка-антигена, соединенного с химерными рецепторами (CARS), которые имеют повышенную антигенную специфичность (рис. 3). Эти подходы могли бы преодолеть фундаментальные ограничения, связанные с центральной и периферической толерантностью, а также генерировать Т-клетки, которые будут более эффективными в плане нацеливания на опухоли без необходимости заново активировать Т-клетки у пациента. Рис 3. Генетически модифицированные TCR для иммунотерапии рака. (А) Ответом Т-клеток можно манипулировать и перенаправлять против рака, улучшая специфичность и сродство к опухолевым антигенам, с помощью генной инженерии эндогенных TCR. (B) Генетически модифицированные TCR: последовательности генов переносятся в Т-клетку, чтобы кодировать новые TCR альфа и бета цепи с различными пептидными специфичностями. Кроме того, могут быть также трансмембранные изменения (красные столбики). Для того, чтобы свести к минимуму межцепочные ложные спаривания с эндогенными TCR выполнены такие модификации, как добавление дисульфидных мостиков (SS). (С) В качестве альтернативы может быть создан сращенный рецептор, химерный антиген-рецептор (CAR). Как правило, он состоят из трех частей: последовательности распознавания [представлен здесь фрагментом антитела, полученной одноцепочечной переменной (ScFv)], трансмембранного элемента и внутриклеточного заказного домена сигнализации (CD3ζ), который также содержит ко-стимулирующие молекулы, такие как CD28 и рецепторы фактора некроза опухоли (TNFR), таких как ОХ-40. Рисунок генетически модифицированных TCR разместил репетитор по химии и биологии Трофимов Д.А.
Примечание к разделу: "Генетически модифицированные Т-клетки в иммунотерапии рака ".
8. То есть проба клеток взятая из живого организма в дальнейшем подвергается различным воздействиям in vitro, то есть колбах или пробирках (перевод с лат.: « в стакане/стекле » ). Например, стволовые клетки, взятые из коленного сустава, затем размножаются в лаборатории и затем вводятся в качестве инъекций в целях восстановления сустава. Процедура, находящаяся в России на заключительной стадии исследования в Центральной Клинической Больнице Управления Делами Президента РФ в Отделении травматологии и ортопедии с нейрохирургическими койками; уточнение значений слов: ex vivo и in vitro добавил репетитор по химии и биологии Трофимов Д.А. 9. Все виды клеток крови: эритроциты, тромбоциты, лейкоциты могут быть получены из клеток костного мозга называемых гемопоэтическими, то есть кроветворными. Эти клетки могут почти неограниченно делиться с последующей дифференцировкой, то есть созреванием с образованием всех видов клеток крови. Но из-за того, что гемопоэтические стволовые клетки обладают способностью интенсивно делиться их используют после лечения онкологических заболеваний с помощью цитостатической химиотерапии и облучения, что приводит к уничтожению собственной кроветворной способности организма. При внутривенном введении эти клетки постепенно заселяют костный мозг и начинают производить все виды клеток крови. В качестве источника гемопоэтических стволовых клеток используются: костный мозг, периферическая кровь или пуповинная кровь, собранная после рождения ребенка.
Пояснение к понятию гемопоэтические стволовые клетки добавил репетитор по химии и биологии Трофимов Д. А. Генетически модифицированные TCR терапии Генетически модифицированные терапии TCR основаны на изменении Т-клеточной специфичности через экспрессию специфических TCR альфа и бета цепей, которые опосредуют процесс антигенраспознвания (рис. 2). В специфических опухолях TCR альфа и бета цепи идентифицированы, выделены и клонированы в трансдуцирующих векторах ( прим.и. Чтобы создать успешный опухольспецифичный TCR, соответствующая целевая последовательность должна быть идентифицирована. Она может быть выделена из редких опухолевых реактивных Т-клеток, или, если это невозможно, альтернативные технологии могут быть использованы для создания высокоактивных противоопухолевых Т-клеточных антигенов. Один подход заключается в иммунизации трансгенных мышей, которые экспрессируют антигенную систему лейкоцитов человека, белками опухоли человека (HLA Box 1) для генерации экспрессирования TCR рецепторов Т-клетки нацеленных на опухолевые антигены.(Станиславский и др., 2001). Альтернативным подходом является аллогенная ( прим. генетически отличающаяся) передачи гена TCR, в которой опухоль-специфические Т-клетки выделяют из организма пациента испытывающего ремиссию опухоли и активную последовательность TCR переносится на Т-клетки от другого пациента, который болеет этой же болезнью, но в нечувствительной форме (Гао и др., 2000; де Витте и др, 2006). И, наконец, in vitro (в пробирке) технологии могут быть использованы для изменения последовательности TCR, повышая их опухоль убивающая активность за счет увеличения силы взаимодействия (авидность) слабо реагирующих опухоль специфических TCR с антигеном-мишенью (Роббинс и др, 2008; Шмид и др, 2010). Химерный антиген рецепторов (CAR) CAR сочетают в себе узнавания двух антител с Т-клеточной активирующей функцией. (Махер, 2012). Они состоят из антигенсвязывающей области, обычно получаемую из антитела (Ешар и др., 1993), трансмембранного домена для закрепления CAR на Т-клетке (Бриджмена и др., 2010), а также одного или более доменов внутриклеточной сигнализации, которые вызывают персистентость, перенос и эффекторные функции в трансдуцированных Т-клетках (Финни и др., 1998;. Krause и др, 1998) (рис. 3). Последовательности, используемые для определения мотива антиген-нацеливания CAR, обычно получают из моноклонального антитела, но лиганды (Муниаппан и др., 2000) и другие рецепторы (Джанг и др., 2012), также могут быть использованы. CAR специфичность часто определяется одноцепочечным вариабельным фрагментом (ScFv - направляющий домен), который формируется самоассоциацией клонированных вариабельных областей тяжелой и легкой цепей моноклональных антител (рис. 3). ScFv связан с помощью гибкой спейсерной области с внутриклеточным сигнальным доменом, как правило, трансмембранным и эндодоменом корецептора CD3ζ. Костимуляторные сигналы, такие как опосредованные CD28, OX40 (рецептор фактора некроза опухоли4) и CD40L, позволяют более эффективную и длительную активацию Т-клеток, но часто опухоли не выражают соответствующие лиганды для таких костимуляторных молекул (Драйзенс и др., 2009). По этой причине, хотя CAR, которые содержат только CD3ζ (первое поколения CAR) были способны индуцировать противоопухолевые реакции, но в большинстве случаев отсутствие костимуляции приводило к иммунной невосприимчивости (анергии) и к нарушению экспансии Т-клеток (прим. клональному увеличению численности) в естественных условиях (Хеслоп, 2010).