Сайт репетитора по химии и биологии Трофимова Д.А.
Главная страница <<предыдущая страница следующая страница>>
Перевод статьи: Михаела Шарпе и Наталии Маунт “Генетически модифицированные Т – клетки в раковой терапии: достоинства и недостатки” репетитором по химии и биологии Трофимовым Д.А. Введение.
Резюме.
Опухоли используют многие стратегии для предотвращения иммунной защиты, включая отрицательную регуляцию 1 и создают иммуносупрессивную окружающую среду. Т – клетки играют ключевую роль в иммунитете являясь клетками –посредниками, и в последнее время используемая стратегия генетически модифицировать Т- клетки или через изменение специфичности рецепторов T – клеток или путем введения распознавателя антител, как в химерных антигенных рецепторах (CARS), сделала существенный прогресс. Потенциал этих достижений демонстрируется в особенности успешным использованием генно-модифицированных Т- лимфоцитов при лечении злокачественных гематологических В – клеток в клинических испытаниях. Клинический успех выражается в росте количества стратегический партнерств в этой области, что привлекло высокий уровень капиталовложений и вовлекло много фармацевтических организаций. Хотя наше понимание факторов, которые влияют на безопасность и эффективность этой терапии увеличиваются, проблемы для использования иммунотерапии генномодифицированных Т – лимфоцитов для многих пациентов остаются. Они начинаются с выбора антигенных целей и включают в себя вопросы управления и безопасности для успешных направлений коммерческих разработок.
Однако, обнадеживающе клинические данные - прогресс в научном понимании иммунологии опухолей и в улучшении изготовления искусственных клеток. Это дает возможность совершенствоваться в клиническом развитии важных иммунотерапий опухолей.
Ключевые слова: иммунотерапия, генная модификация, ТСР, САR, Т – клетки, онкология, эффективность, безопасность, регуляция, производство, клинические испытания.
Примечание к резюме.
1. Положительная регуляция, наоборот, при увеличении количества антигенов приводит к увеличению числа лимфоцитов, которые будут подавлять рост и уничтожать микроорганизмы, чужеродные клетки или вирусы, попавшие в организм человека. Уточнение для отрицатеьной регуляции добавил репетитор по химии и биологии Трофимов Д. А.
Ведение.
Иммунная система обладает двумя оружиями: врожденная и приобретенная иммунные системы (рис.1) Благодаря иммунной защите любая молекула, которая идентифицирована как не своя, уничтожается. Цели включают не только различные инфекционные клетки, но также трансформированные клетки опухоли, которые могут приобрести антигенность2 и, следовательно, обладают иимуногенностьюь3 , благодаря которой они опознаются как чужеродные. Однако клетки опухоли создают стратегию для избегания воздействия и для подавления иммунной системы (Пинзон-Чарри и др., 2005; Бланкенштайн и др., 2012), результат которой проявляется в неудачном инициировании и поддержании надежного противоопухолевого иммунитета и, следовательно, облегчается выживаемость и развитие клеток опухоли. Стратегии включают образование опухолевых антигенов, являющимися слабыми иммуногенами. Альтернативно, опухоли могут использовать отрицательную регуляцию или регуляцию антигенной модуляции4
Кроме того, опухоли могут подавлять иммунный ответ посредством синтеза различных иммунодепрессантов, которые играют роль в поддержании аутотолерантности (прим. аутотолерантности -толлерантность к антигенам собственного организма), чтобы подавить эффекторную функцию лимфоцитов. Опухоли воздействуют подавляюще на все ветви иммунной системы в результате чего они избегают ее воздействие. Так как наше понимание иммунной системы продвинулось, все большее количество инновационных терапий развивается с использованием клеток иммунной системы и оптимизированием их реагирования на больные клетки благодаря генной модификации. Это особенно успешно в области опухолевой медицины. При овладении или улучшении функций специфических иммунных клеток существует возможность усиления иммунного ответа для достижения длительной регрессии рака. За последние 20 лет иммунноклеточная терапия против опухолей основанная на аутологичных (полученные из организма пациента)5 или аллогенных (полученные от доноров) (смотрите раздел 1 глоссария терминов) иммунных клетках, вводимых в пациентов, были широко протестированы в клинических испытаниях. Сюда включается терапия естественными убийцами клеток (NKC; смотрите раздел 1, Ченг и др., 2013; Миллер, 2013), терапия дентритными клетками (DC; см. раздел 1, Палучка и др., 2011; Ваччелли и др., 2013) и иммунотерапия генномодифицированными Т – лимфоцитами (Давила и др., 2014; Маус и др. 2014)
Учитывая их растущее значение в качестве потенциального лечения некоторых форм рака и их формирующегося клинического успеха, мы ориентируем этот обзор на разработке стратегий лечения, которые используют генетически модифицированные Т-клеточные иммунотерапии.
Прогресс в наших знаниях иммунологии опухолей, улучшение в производстве продуктов иммунотерапии и способности выбрать пациентов чье выражение опухолевых специфичных антигенов улучшают клинический результат иммунотерапии генномодифицированными Т – лимфоцитами. Тем не менее, как мы обсудим, проблемы в этой развивающейся области, связанные с эффективностью, безопасностью и производством этих видов лечения, а также контролировании, остаются.
Примечание к введению.
1. Положительная регуляция, наоборот, при увеличении количества антигенов приводит к увеличению числа лимфоцитов, которые будут подавлять рост и уничтожать микроорганизмы, чужеродные клетки или вирусы, попавшие в организм человека. Уточнение к понятию положительная регуляция добавил репетитор по химии и биологии Трофимов Д. А.
2. Слово antigen сокращенно произошло от греч. anti- против и gennao - создавать, производить, то есть созданный против, чужеродный. Антиген может быть белком или полисахаридом, как часть микроорганизма, а также липидом и нуклеиновой кислотой, но уже в обязательном комплексе с белком, он может быть и немикробного происхождения: цветочной пыльцой, яичным белком и белком трансплантатов тканей и органов. Чем больше молярная масса антигенна, тем большей антигенностью они обладают. Атигенность является характеристикой качества антигена, и может определяться количеством антител, которые образуются как иммунный ответ на данный антиген.
В – лимфоциты и макрофаги могут запросто узнавать антигены и с аппетитом заглотив вирус эти клетки активно расщепляют его белок на фрагменты, полипептиды, которые презентируются МНС белком, а вот Т – лимфоциты, могут разглядеть только уже препарированный вирус в виде его фрагментов презентированные на МНС белках В – лимфоцитов и макрофагов, этакая специфичная клеточная близорукость (см. иммунный ответ)
Примечание о антигенах и антигенности составил репетитор по химии и биологии Трофимов Д. А.
3. Иммунный ответ.
Любые инородные тела и микроорганизмы, попавшие в организм человека, могут вызвать интереснейшую и сложнейшую цепь превращений результатом которой станет иммунный ответ, который уничтожит нарушителей здоровья. Причем происходящие события запечатлеются в ‘памяти” на долгое время, чтобы при воздействии таких же по природе факторов наготове была уже целая армия защитников, натренированная на войну именно с этим типом захватчиков. Баталии, которые при этом разворачиваются могли бы удивить и прославленных полководцев, видавших виды на полях сражений. Результатом слаженной работы грандиозной цепи событий и превращений, наступления и обороны, удачных маневров и хитроумно созданных засад мы получаем в свое полное распоряжение крепкое сибирское здоровье, которым можем гордиться, если конечно заботимся о нем. Нельзя пренебрегать закаливающими процедурами, физическими упражнениями, йогическими растяжками, правильным питанием без алкоголя и курения и конечно же духовным развитием. Что же все-таки произойдет если супостат – микроорганизм или, того хуже, инородный белок, рискнут вторгнуться в границы нашего королевства, то есть человеческого тела? Давайте сядем поудобней в кресло помягче и попробуем собственными глазами увидеть, как будут развиваться грандиозные военные события. И если однажды болезнь все-таки рискнет нас посетить, быть может, наше понимание происходящего помогут воинам нашей иммунной системы справиться с врагом гораздо быстрее! Итак, приступим к разворачиванию событий битвы.
Итак, когда я в общих чертах обрисовал воинов, бесстрашно бьющихся за наше здоровье можно начать описание самой битвы.
Как только где-нибудь в транспорте или в классе носитель инфекции, которому дома не сидится, а хочется заразить как можно больше себе подобных индивидуумов, чихнет миллиарды искателей приключений, бактерий и вирусов, устроившись поудобней на капельках слюны устремляются во все стороны. Теперь достаточно вдохнуть неосторожным соседям, не обремененным респираторными масками с размерами пор не позволяющими проникнуть сквозь них капелькам слюны, как в организм внедряются непрошенные и крайне нежелательные гости.
Первыми кто сталкивается с ними это макрофаги. Напоминают по форме амебу и также любят лакомиться фагоцитозом, но предпочитают в своем меню иноземных непрошенных гостей.
Как только инородная белковая частица переварится и расщепится на составные пептидные части одна из них будет выставлена на всеобщее обозрение (презентируется) для порицания окружающих, а также для того, чтобы привести весь мощный оборонный комплекс в состояние войны. Называться этот пептид (молекула, состоящая из аминокислотных остатков в количестве не более 100) теперь антигеном. этот антиген прикрепляется не куда-нибудь, а к специально предназначенному месту, к белку главного комплекса гистосовместимости ГКГС (МНС от англ. major histocompatibility complex).См. рисунок
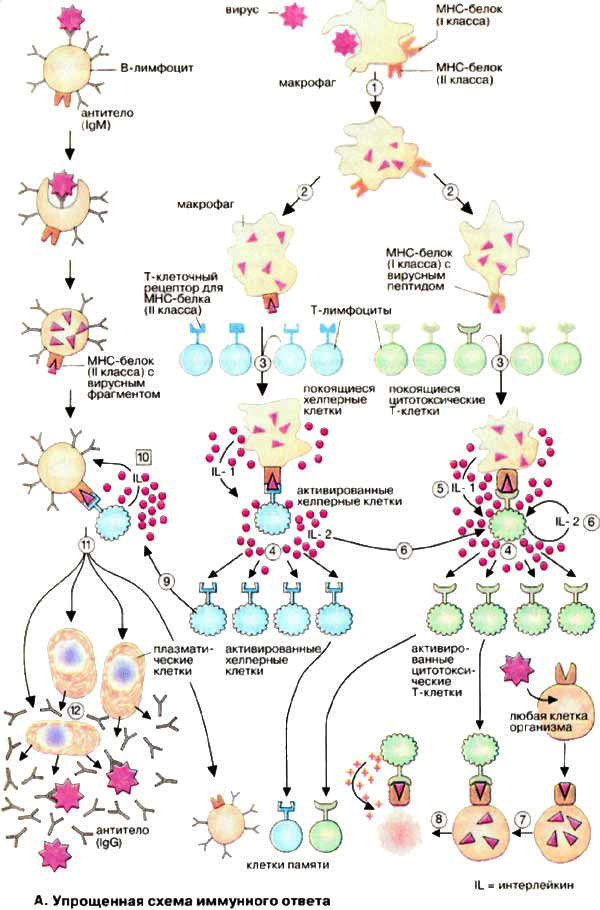
Рисунок с упрощенной схемой иммунного ответа из книги: наглядная биохимия, Я. Кольмана разместил репетитор по химии и биологии Трофимовым Д.А.
Сам комплекс находится в 6 хромосоме в виде большого семейства генов, кодирующих МНС – белок. Причем МНС – белок I класса презентирует антиген, который образовался в протеасо́ме (от англ. protease — протеиназа и лат. soma — тело), то есть протеасомы расщепляет чужеродные белки на мелкие фрагменты (антигены) внутри клетки макрофага, и эти фрагменты прикрепляются к МНС – белкам I класса макрофага. Этими белками снабжены все клетки, а вот МНС – белками II класса, обеспечены только наиболее заслуженные участники внутриорганизменных баталий, то есть клетки иммунной системы.
Как только беззаботно прогуливающийся Т – киллер столкнётся своим Т – клеточным рецептором с презентированным вражеским антигеном, то немедленно соединится с ним10. Их крепкие объятия приводят к активному выделению интерлейкинов. Макрофаг, как я уже говорил выделяет IL-1, а Т – киллер - IL2, который предназначен для порождения многочисленных клонов, копий Т – киллера. Один в поле не воин! Причем многочисленные образовавшиеся воины – защитники находятся в состоянии боевой готовности, то есть активированы! Теперь достаточно соприкоснуться их Т – клеточным рецептором с антигеном презентированным МНС – белком I класса клетки зараженной вирусом или бактерией, как Т – киллеры начинают секретировать фермент перфорин, который делая мембрану зараженной клетки проницаемой, заставляет инфицированную клетку лизировать, то есть разрушаться.
МНС – белок II класса макрофага, не теряя даром времени, презентирует антиген микроорганизма и соединяется с Т – клеточным рецептором, но уже Т – хелпера. На радостях встречи они начинают активно образовывать интерлейкины, аналогично предыдущему описанию соединению макрофагов и Т – киллеров. Точно также образуются множество Т – хелперных клеток с активным боевым духом. Любой из них соединившись с В – лимфоцитом с презентированным МНС – белком II класса антигеном, что также порождает активное клонирование и пролиферацию, размножение B – лимфоцитов, а интерлейкин, который выделяет Т – хелперная клетка, стимулирует созревание B – клетки, то есть ее превращение в плазматические клетки способные синтезировать и секретировать многочисленные антитела, способные непосредственно уничтожать противника, не нуждаясь во вспомогательных церемониях, как то презентация МНС – белками, напоминая тем самым пехотинцев. Примечание о работе иммуного ответа добавил репетитор по химии и биологии Трофимов Д. А.
4. Иммунная система не распознает опухоли поскольку часть макромолекулы антигена опухоли или антигенная детерминанта, называемая эпитопом, узнается паратопной частью антитела и исчезает с поверхности клетки.
5. Стволовые клетки пуповинной крови расматриваются иммунной системой организма ребенка как свои, поскольку были получены из его пуповинной крови. Стволовые клетки костного мозга взрослого донора таккже считаются своими его организмом.