Ответы на все задания досрочного ЕГЭ 2015 года репетитора по химии Трофимова Д.А. смотрите в разделе: "подготовка к ЕГЭ". Ким можно найти в том же разделе.
Электронная формула внешнего электронного слоя 3s23p6соответствует строению каждой из двух частиц:
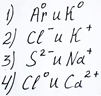
Задание №1 части А досрочного ЕГЭ 2015 года перенесенное с сайта ФИПИ репетитором по химии Трофимовым Д.А.
Что бы правильно ответить на этот вопрос нужно ознакомиться с теорией.
Путешествие в мир энергетических уровней, электронных формул атома и числа электронов в нем с репетитором по химии.
С точки зрения квантовой физики орбиталь - это пространство, в котором вероятность нахождения электрона максимальна. Если бы можно было фотографировать электрон в течение некоторого времени в атоме водорода, то мы увидели следующую картину:
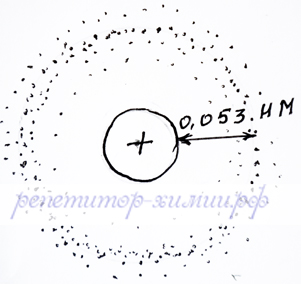
Электронное облако водорода, с наиболее частым нахождением электрона на расстоянии 0,054 нм, представлено репетитором по химии Трофимовым Д.А.
Из этого рисунка можно увидеть, что электрон атома водорода чаще всего бывает на расстоянии 0,053 нм. Таким образом, s – орбиталь представляет собой сферу, на поверхности которой чаще всего бывает электрон.
p - орбиталь имеет форму объемной восьмерки или гантели. Каждый p – подуровень состоит из трех p – орбиталей располагающихся вдоль осей координат: x, y и z. Соответственно они будут называться: px ; pу и pz орбиталями.
d - орбитали: одна из них похожа на p - орбиталь с поясом подобным кольцу Сатурна около центра, а остальные 4 орбитали образованы как бы двумя р – орбиталями находящихся под углом 90 градусов друг к другу. Соотвественно, d – подуровень содержит пять d – орбиталей, расположенных под разными углами.
f – орбитали не имеют наглядных геометрических представлений. Каждый f – подуровень содержит семь f – орбиталей.
На каждой орбитали может находиться не больше двух электронов, отличающихся друг от друга напра влением вращения вокруг своего центра. Если один электрон вращается по часовой стрелки, то другой – против часовой стрелки. То есть они отличаются спинами. Spin – веретено в английском языке. Таким образом, максимальное число электронов на s – подуровне соответствует 2, так как он состоит из одной орбитали. На p – подуровне – 6, поскольку его составляет три орбитали. d – подуровень содержит 10 электронов, располагающихся на 5 орбиталях. На f – подуровне максимальное число электронов уже 14 и размещаются они на 7 орбиталях по два электрона на каждой. Смотрите таблицу:
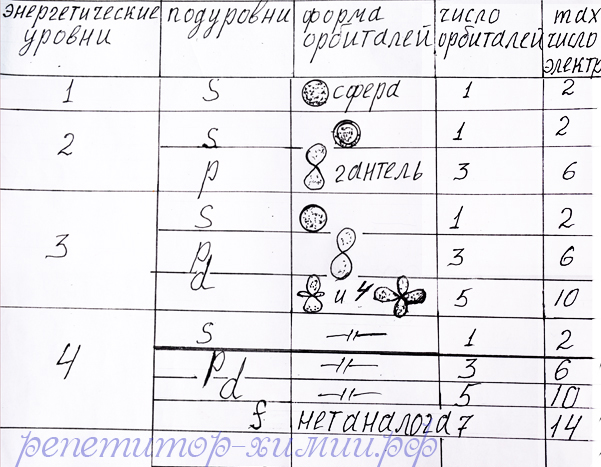
Таблица с числом орбиталей и максимальным числом электронов распологающихся на - энергетических уровнях и подуровнях созданная репетитором по химии Трофимовым Д.А.
На нижерасположенном рисунке можно увидеть, как электроны заполняют орбитали поочередно по мере роста их энергии. На данном рисунке видно, что заполнение электронами орбиталей начинается с ближайшей к ядру 1s - орбиталь с минимальной энергией. Затем заполняется более отдаленная 2s – орбиталь обладающая большей энергией. После ее заполнения двумя электронами начинается заполнение трех p –орбиталей, обладающих еще большей энергией. На каждой орбитали может распологаться не больше двух электронов.
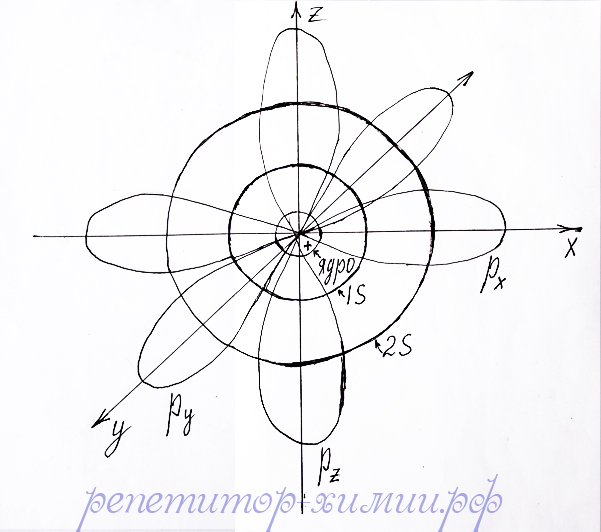
Строение атома элементов 2 периода состоящего из 1s, 2s и 2p - подуровней показано репетитором по химии .
Порядок заполнения электронами подуровней следующий:

Используемая в электронных формулах последовательность энергетических уровней и подуровней с максимальным числом электронов на них приводится репетитором по химии Трофимовым Д.А.
Цифра перед s, p и d, подуровнем означает номер уровня равного номеру периода. А цифра над каждым подуровнем означает максимальное число электронов, которое может располагаться на нем. После заполнения 4s - подуровня двумя электронами заполняется 3d - подуровень, энергия которого ниже чем энергия 4p - подуровня. Из следующего рисунка виден рост энергии электронов по мере заполнения энергетических подуровней. Заметно, что порядок заполнения электронами подуровней: 4s - 3d - 4p:
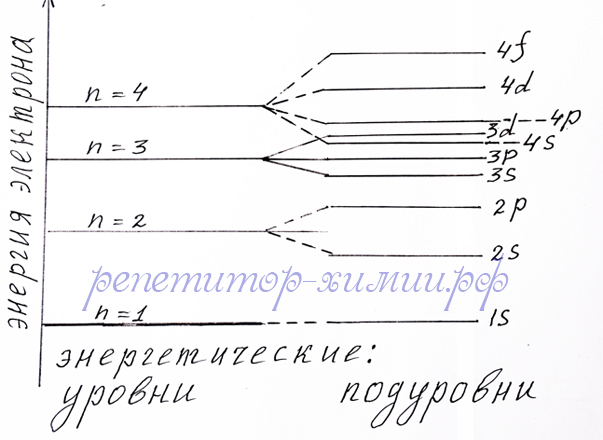
Схема зависимости энергии электронов в атоме от положения на энергетических уровнях и энергетических подуровнях нарисована репетитором по химии Трофимовым Д.А.
Аналогично заполняются электронами 5s - 4d - 5p подуровни. А начиная с 6 энергетического уровня после 6s - подуровня заполняется f - подуровень 4 уровня, а затем 5d - подуровень. В последнюю очередь - 6p - подуровень.
Создание электронных формул атомов химических элементов.
Теперь полученных знаний достаточно для написания электронных формул атомов химических элементов. Начнем с первого элемента таблицы элементов - водорода. Символ водорода записывается c нижней левой стороны цифрой означающий порядковый номер элемента, то есть число протонов. У водорода - 1 протон, как у самого первого элемента вселенной. Цифра слева вверху означает массовое число А.
А = Z +N ; где Z - число протонов, а N = число нейтронов в атоме.
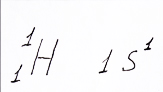
Электронная формула водорода, 1 электрон распологается на 1s подуровне, составлена репетитором по химии Трофимовым Д.А.
Следующий элемент – гелий. Он отличается от водорода еще одним протоном и, для поддержания нейтрального заряда атома, электроном, который располагается на той же 1s орбитали. Электронная формула гелия выглядит так:
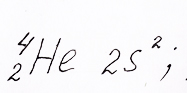
Электронная формула гелия с заполненным полностью 1s - энергетическим подуровнем размещена репетитором по химии Трофимовым Д.А.
Теперь перейдем к третьему элементу таблицы Менделеева - литию. Появляется еще один протон и электрон, который занимает уже 2s – орбиталь поскольку на одной орбитали может размещаться не более двух электронов. Общее число электронов у него -3. Энергия третьего электрона соответственно выше, чем у первых двух:
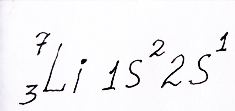
Электронная формула лития с тремя электронами на двух энергетических уровнях. Два из них на 1s – орбитали, а третий на 2s – орбитали, объяснено репетитором по химии Трофимовым Д.А.
После того как четвертый электрон у атома элемента бериллия займет 2s – орбиталь, следующему пятому электрону у атома элемента бора остается расположиться на одной из 2p – орбиталей:
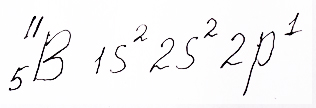
Электронная формула бора с пятью электронами на двух энергетических уровнях, на которых расположены два электрона на 1s – орбитали, два на 2s – орбитали и третий электрон на 2p – орбитали, представлена репетитором по химии Трофимовым Д.А.
Атом азота имеет общее число электронов -семь. От бора азот отличается двумя протонами и двумя электронами, последние занимают p – орбитали второго уровня, на котором теперь пять электронов. Они располагаются следующим образом:
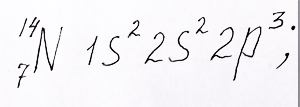
Электронная формула азота, с двумя электронами на 1s – орбитали, двумя на 2s – орбитали и тремя электронами на трех 2p – орбиталях, предоставлена репетитором по химии Трофимовым Д.А.
Неон завершает второй период. У него 10 протонов и 10 электронов. Он отличается от азота тремя электронами, расположенными на 2p – подуровне:
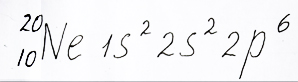
Электронная формула неона, с двумя электронами на 1s – орбитали, двумя на 2s – орбитали и шестью электронами на трех 2p – орбиталях, представлена репетитором по химии Трофимовым Д.А.
Мы завершили рассмотрение элементов второго периода. Элементы с большими порядковыми номерами обладают аналогичным вторым энергетическим уровнем. Последующие слои будут заполняться электронами, но второй слой меняться уже не будет, оставаясь соответствующим неону.
Переходим к заполнению электронами третьего энергетического уровня. Первый элемент третьего периода – натрий. У него число электронов равно 11. Поскольку от аргона натрий отличается протоном и электроном, то этот электрон помещается на s энергетическом подуровне третьего энергетического уровня, то есть на s – орбитали:
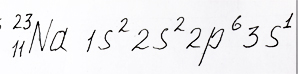
Электронную формулу атома элемента натрия с одним валентным электроном на 3s энергетическом подуровне предоставил репетитором по химии Трофимов Д.А.
Если один электрон с внешнего электронного слоя натрия будет отдан атомом, то электронная формула йона натрия с положительным зарядом будет иметь вид:
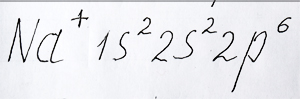
Электронная формула иона натрия с внешним уровнем элемента аргон разместил репетитор по химии Трофимов Д.А.
Заполнение электронами в атоме внешнего 3 энергетического уровня аналогично 2 энергетическому уровню. Для атома сера с общим числом электронов - 16 электронная формула следующая:
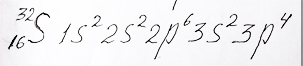
Электронная формула атома серы с двум электронами на внешней s - орбитали и 4 электронами на p - орбиталях разместил репетитор по химии Трофимов Д.А.
Атом серы, принимая два электрона, завершает внешний энергетический уровень до 8 электронов на нем. Теперь ион серы содержит число электронов равное 18:
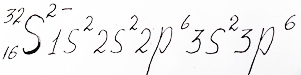
Электронную формулу отрицательно заряженного иона сера с внешним энергетическим уровнем как у элемента аргон предлагает репетитор по химии Трофимов Д.А.
Для получения атома хлора добавим еще один электрон на p - орбиталь 3 энергетического уровня и, таким образом, число электронов в атоме достигнет 17:
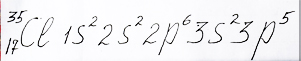
Электронная формула атома элемента хлора: 2 электрона распологаются на 3s энергетическом подуровне и 5 электронов на 3p - подуровне , составлена репетитором по химии Трофимовым Д.А.
Теперь, добавив к атому хлора еще один электрон, получим ион хлора с зарядом минус и общим число элетронов равным 18:
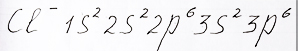
Электронная формула иона хлора, 2 электрона занимают 3s подуровень и 8 электронов располагаются на 3p - орбиталях, представлена репетитором по химии Трофимовым Д.А.
4 энергетический уровень начинает заполняться, по прежнему, с s - орбитали. У калия один электрон на ней:
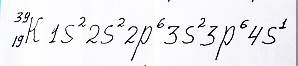
Электронная формула калия с одним неспаренным электроном на 4s - подуровне добавлена репетитором по химии Трофимовым Д.А.
Ион калия образуется после того как атом калия отдаст один электрон с внешнего 4s - подуровня:
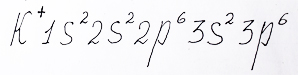
Электронная формула иона калия с внешем уровнем элемента аргон объяснена репетитором по химии Трофимовым Д.А.
Таким образом, можно видеть, что правильный ответ на задание №1 ЕГЭ ФИПИ будет - 2, поскольку и отрицательный ион хлора и положительно заряженный ион калия имеют электронную конфигурацию внешнего энергетического уровня, как у аргона.
Электронная формула аргона после заполнения всех 3p - орбиталей:
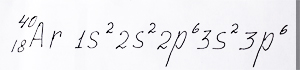
Электронную формулу атома аргона с двум электронами на внешней s - орбитали и 6 электронами на внешних p - орбиталях разместил репетитор по химии Трофимов Д.А.
Заполнение электронами атома кальция находящегося, так же как и калий в четвертом периоде соответствует следующей электронной формуле.
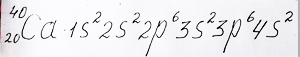
Электронную формулу атома элемента кальция с двумя электронами на внешней s - орбитали предлагает репетитор по химии Трофимов Д.А.
А теперь отберем у атома кальция два электрона превратив его в ион:
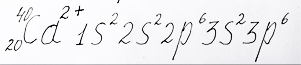
Электронную формулу иона кальция образовавшегося после потери атомом двух внешних электронов и с внешним уровнем элемента аргон разместил репетитор по химии Трофимов Д.А.
Мы разобрались с основными сведениями раздела квантовой механики применительно к заданиям ЕГЭ на эту тему. Теперь можно будет с легкостью отвечать на вопросы подобные заданию №1 ЕГЭ. Если желаете узнать, как заполняются электроны в атомах элементов побочных подгрупп, а так же у лантаноидов и актиноидов или что такое графические электронные формулы и у каких элементов наблюдается явление проскока электрона, записывайтесь на мои занятия по химии.