
Главная страница <<предыдущая страница следующая страница>>
Рассмотрим решение задачи № 39 ЕГЭ по химии части С досрочного КИМа 2015 года.

Условия решаемой задачи взятой с официального сайта ФИПИ приводятся репетитором по химии Трофимовым Д.А.
Ким можно найти по данному адресу на официальном сайте ФИПИ:
Ответы на все задания КИМа репетитора по химии Трофимова Д.А. можно увидеть по ссылке:
Решение досрочного КИМа за 30 минут
Составляем уравнение химической реакции взаимодействия гидрооксида калия и хлорида аммония с образованием аммиака:
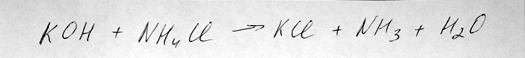
Реакция обмена составлена репетитором по химии Трофимовым Д.А.
Находим количество гидрооксида калия и хлорида аммония: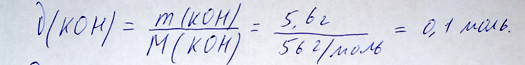
Расчет количества едкого калия репетитором по химии Трофимовым Д.А.
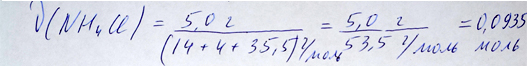
Расчет количества нашатыря репетитором по химии Трофимовым Д.А.
Подставляем в уравнение химической реакции над соответствующими веществами и переносим недостаток, то есть количество хлорида аммония, на аммиак в соответствии со стехиометрическим коэффициентами:
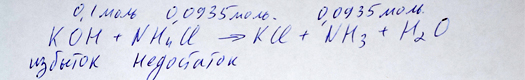
Подстановка количеств веществ и перенос недостатка на аммиак репетитором по химии Трофимовым Д.А.
Находим массу получившегося аммиака, умножив количество образовавшегося аммиака на молярную массу аммиака:
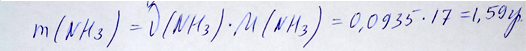
Расчет массы аммиака, образовавшегося в реакции, репетитором по химии Трофимовым Д.А.
Определяем массовую долю аммиака, разделив массу аммиака на массу раствора, который образовался при растворении газа в 50 г. воды:
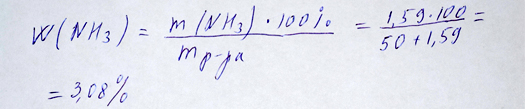
Массовая доля аммиака вычислена репетитором по химии Трофимовым Д.А.
Переходим к решению второй части задачи. Химические вещества, участники химического превращения, азотная кислота и аммиак. Составляем уравнение реакции
взаимодействия азотной кислоты и аммиака с образованием нитрата аммония. Реакции соединения. Весь аммиак, выделившийся из первой реакции, полностью вступает в реакцию с азотной кислотой. Поэтому, подставив количество аммиака в уравнение химической реакции переносим его на азотную кислоту в соотношении один к одному:
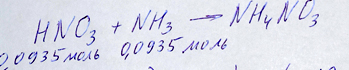
Реакция соединения аммиака и азотной кислоты и перенос количества аммиака на кислоту репетитором по химии Трофимовым Д.А.
Находим массу азотной кислоты, умножив количество азотной кислоты вступившей в реакцию с аммиаком на молярную массу азотной кислоты.
Вычисляем массу раствора азотной кислоты, разделив массу чистой азотной кислоты на массовую долю азотной кислоты и умножив на сто процентов.
Определяем объем раствора азотной кислоты разделив массу раствора азотной кислоты на плотность раствора азотной кислоты:
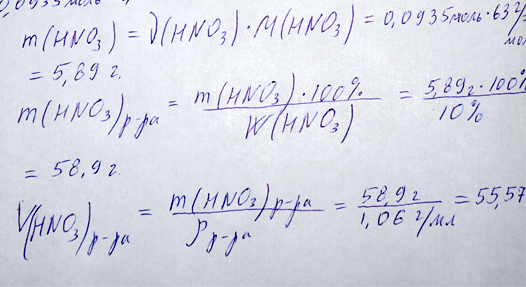
Вычисления массы азотной кислоты, массы и объема раствора кислоты репетитором по химии Трофимовым Д.А.
Ответ: Массовая доля аммиака 3.08%. Объем 10 % раствора азотной кислоты с плотностью 1,06 г/мл равен 55, 57 мл.
1) сульфата меди(II) и хлорида натрия
2) нитрата кальция и азотной кислоты
3) хлорида меди(II) и гидроксида бария
4) соляной кислоты и нитрата лития
Что бы правильно ответить на этот вопрос надо ознакомиться с понятиями - амфотерные соединения. Они делятся на: амфотерные металлы, амфотерные оксиды и амфотерные основания. Амфотерные металлы реагируют как с кислотами, так и с основаниями. Поэтому цинк может взаимодействовать как с кислотами, так и с щелочами. Рассмотрим взаимодействие цинка с серной кислотой. Водород из кислот могут вытеснять металлы, находящиеся в ряду активности металлов левее водорода, поэтому цинк вполне может справиться с поставленной задачей:
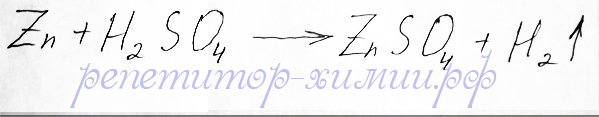
Реакция замещения водорода цинком размещена репетитором по химии Трофимовым Д.А.
Так как цинк - амфотерный металл, то и взаимодействие с гидрооксидом бария в присутствии воды, возможно:
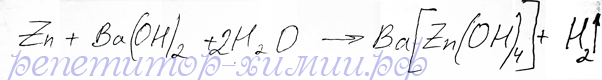
Реакция образования комплексного соединения тетрагидроксоцинката бария при взаимодействии цинка с раствором гидрооксида бария составлена репетитором по химии Трофимовым Д.А.
Взаимодействие с хлоридом меди цинка относится к типичным реакциям замещения более активным металлом менее активного. (Занимайтесь в тренажерном зале, что бы не оказаться на месте менее активных металлов!) Не забывайте, что в этих реакциях нельзя вытеснить металлы первой и второй главной подгруппы с кальция и ниже. Нельзя также этими же очень активными металлами вытеснить менее активные металлы из-за их пристрастия к бурным реакциям с водой! Поэтому они, вместо того, что бы тихо и добропорядочно вытеснять менее активные металлы, начнут с треском и пламенем ( щелочные металлы, все таки) выгонять из воды водород! Например, нельзя вытеснить металл из раствора соли этого металла натрием, поскольку натрий будет взаимодействовать с водой раствора с образованием гидрооксида натрия, вместо того, что бы вытеснять менее активный металл из соли.

Реакция замещения цинком меди из раствора хлорида меди для пояснения свойств цинка приведена репетитором по химии Трофимовым Д.А.
Следовательно правильный ответ на задание А7 будет- 3).
Продолжу начатую тему амфотерные соединения, как одну из сложных тем ЕГЭ. Амфотерные оксиды проявляют как кислотные, так и основные свойства. Располагаются металлы образующие амфотерные оксиды и основания на пересечении диагонали водород – астат или, если это элементы побочных подгрупп, в некотором удалении от нее. Но это примерное определение местоположения. Что бы не ошибаться, запомните соединения, которые обладают амфотерным характером! Вот их перечень в рамках требований ЕГЭ:
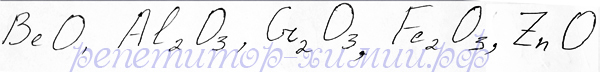
Эти амфотерные оксиды надо выучить для сдачи ЕГЭ - рекомендация репетитора по химии Трофимова Д.А.
Оксид цинка с раствором щелочи образует комплексное соединение- цинкат калия, проявляя в этой реакции свойства кислотного оксида:
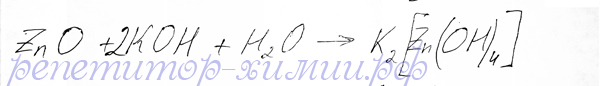
Реакция обменного типа между оксидом цинка и едким калием представлена репетитором по химии Трофимовым Д.А.
Взаимодействие с хлоридом меди цинка относится к типичным реакциям замещения более активным металлом менее активного. (Занимайтесь в тренажерном зале, что бы не оказаться на месте менее активных металлов!) Не забывайте, что в этих реакциях нельзя вытеснить металлы первой и второй главной подгруппы с кальция и ниже. Нельзя также этими же очень активными металлами вытеснить менее активные металлы из-за их пристрастия к бурным реакциям с водой! Поэтому они, вместо того, что бы тихо и добропорядочно вытеснять менее активные металлы, начнут с треском и пламенем ( щелочные металлы, все таки) выгонять из воды водород! Например, нельзя вытеснить металл из раствора соли этого металла натрием, поскольку натрий будет взаимодействовать с водой раствора с образованием гидрооксида натрия, вместо того, что бы вытеснять менее активный металл из соли.

Реакция замещения цинком меди из раствора хлорида меди для пояснения свойств цинка приведена репетитором по химии Трофимовым Д.А.
С серной кислотой оксид цинка, проявляя свойства основного оксида, образует соль – сульфат цинка: :
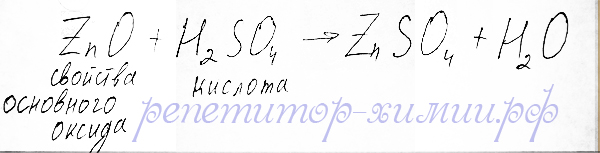
Реакция обменного типа при взаимодействии оксида цинка и серной кислоты размещена репетитором по химии Трофимовым Д.А.
Гидрооксид цинка реагирует подобно оксиду цинка с раствором щелочи, но вода в уравнение реакции не входит, хотя ее присутствие для образования комплексного соединения обязательно:
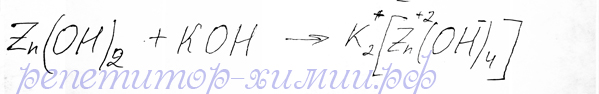
Реакцию обменного типа между гидрооксидом цинка и едким калием с образованием тетрагидрооксоцинката калия добавляет репетитор по химии Трофимов Д.А.
Оксид железа(III) не взаимодействуя с растворами щелочей, тем не менее, проявляет амфотерные свойства при сплавлении щелочами:
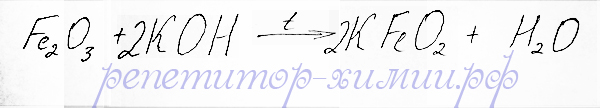
Реакция обменного типа между оксидом железа(III) и гидрооксидом калия для пояснения амфотерности репетитором по химии Трофимовым Д.А.
И при взаимодействии с кислотами:

Реакция обменного типа между оксидом железа(III) и серной кислотой доказывает амфотерный характер первого и размещается репетитором по химии Трофимовым Д.А.
А теперь рассмотрим свойства солей слабых кислот трехвалентных металлов. Как правило, абитуриент не знает, что они разлагаются водой с образованием не растворимого основания и слабой кислоты или газа, и поэтому за это задание ЕГЭ получает 0 баллов:

Пример разложения солей слабых кислот 3-х валентных металлов водой предоставлен репетитором по химии Трофимовым Д.А.
Подобная соль могла бы образоваться в реакциях обменного типа, но вместо нее надо писать продукты разложения водой, которые я показал в предыдущей реакции:

Возможное появление в продуктах реакции карбоната алюминия, который, не успев образоваться, разлагается водой на гидрооксид алюминия и углекислый газ – пояснение репетитора по химии Трофимова Д.А.
Сульфид железа (III) не разлагается водой, и не растворим в ней. В этой окислительно - восстановительной реакции образование сульфида железа (III) не происходит, поскольку катион железа с зарядом 3+ обладает окислительными свойствами и будет принимать электрон от аниона серы с зарядом 2- с образованием иона железа 2+. Ион серы, отдавая два электрона, превратится в серу с нулевым зарядом, то есть в чистую серу:
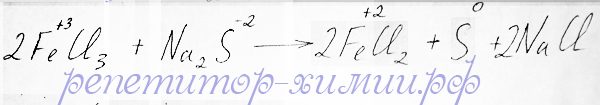
Окислительно-восстановительная реакция, в которой катион железа с зарядом +3 являясь окислителем, окисляет анион серы до чистой серы, предложена репетитором по химии Трофимовым Д.А.
Таким образом, зная окислительные свойства трехзарядного иона железа можно ответить на вопрос досрочного ЕГЭ ФИПИ.
В задании № 31 в строчке – Г находится сульфат железа (III) и предлагается найти три вещества, с которыми он будет реагировать. Для ответа на вопрос подходит третья строчка справа, поскольку иодид калия реагирует с сульфатом железа (III) по типу ОВР:
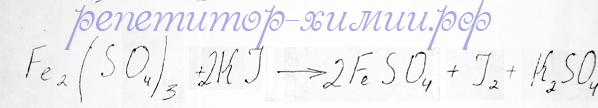
Окислительно – восстановительная реакция между сульфатом железа (III) и иодидом калия с образованием йода и сульфата железа (II) размещается репетитором по химии Трофимовым Д.А.
Следующая реакция между солью и щелочью третьей строчки осуществляется следующим образом:
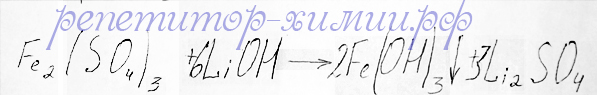
Реакция обменного типа между сульфатом железа (III ) и гидрооксидом лития с образованием гидрооксида железа (III) и сульфата лития из задания № 31 предлагается репетитором по химии Трофимовым Д.А.
Взаимодействие третьего реагента – соли хлорида бария с cульфатом железа (III) приводит к образованию осадка сульфата бария, что делает данную реакцию необратимой:
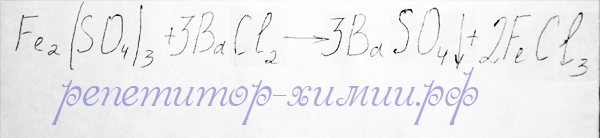
Необратимая реакция между средними солями: cульфатом железа (III) и хлоридом бария с образованием осадка сульфата бария добавляется репетитором по химии Трофимовым Д.А.
Таким образом, мы отлично подготовились к тем заданиям ЕГЭ, которые требуют знания тем: - амфотерные соединения и разложение водой солей слабых кислот 3-х валентных металлов. Увидели исключения из этого правила. Расмотрели окислительную способность иона железа с зарядом +3.
Продолжение данной темы в свете качественных реакций на амфотерные соединения, а также объяснение других, не менее важных тем для сдачи ЕГЭ, планируется в следующих статьях. Рекомендую добавить сайт в закладки, что бы не пропустить этой информации необходимой для успешной сдачи ЕГЭ на высокий балл!